Епідеміологія бета-гемолітичного стрептокока
Піогенний (гноєтворні) бактерії викликають цілий ряд захворювань: гнійничкові хвороби шкіри та м’яких тканин (абсцеси, флегмони, фурункули, остеомієліт), ангіни і фарингіти, бронхіти, ревматизм, скарлатину і токсичний шок.
З’ясування типу мікроба, який викликав захворювання, необхідно для вирішення питання проведення курсу лікування антибіотиками. Захворювання, причиною якого є бета-гемолітичні стрептококи, необхідно лікувати антибіотиками.
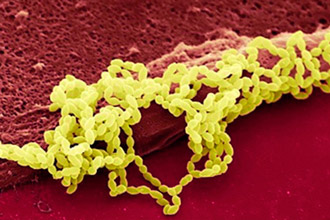
Рис. 10. На фото гемолітичні стрептококи pyogenes, БГСА.
Рис. 11. На фото стрептодермія у дитини.
Рис. 12. На фото стрептодермія у дитини.
Рис. 13. На фото стрептококове імпетиго — гнойничковое ураження шкіри.
Рис. 14. На фото поєднання флегмонозно і фіброзної ангіни. Єдина белесоватая плівка захоплює мигдалину і виходить за її межі.
Рис. 15. Паратонзилярный абсцес. На малюнку бачимо кулясте утворення, що зміщує піднебінні дужки і м’яке небо в протилежну сторону.
Рис. 16. Фурункул носа.
Рис. 17. На фото кон’юнктивіт.
Рис. 18. Бешихове запалення гомілки.
Стрептококи агалактиэ мешкають в носоглотці, шлунково-кишковому тракті і в піхву вагітних. Вони є причиною пневмонії, сепсису і менінгітів у половини новонароджених, народжених від інфікованих матерів.
Після респіраторних вірусних інфекцій саме S. agalactiae стають причиною розвитку стрептококових пневмоній. Це відбувається через зниження імунітету і наступним за цим активацією бактеріальної мікрофлори в носоглотці, пов’язаного з впливом на організм вірусної інфекції.
Рис. 19. На фото стрептококи агалактиэ (Streptococcus agalactiae).
Скарлатина – так звана дитяча інфекція стрептококкой природи. Початок хвороби гострий з підйомом температури до високих цифр, появою слабкості, млявості, загального занепаду сил, зниження апетиту. Далі виникають явища ангіни – гіперемія і набряклість мигдалин, нальоти, як правило, відсутні.
Типовим для скарлатини є так званий малиновий язик яскраво-червоний, іноді з збільшеними лімфатичними фолікулами. На 3-4 день хвороби відразу по всьому тілу поширюється мелкоточечная рожево-червона висипка, інтенсивність якого наростає при натисканні.
Через кілька днів висип зникає, змінюється дрібно – і крупнопластинчатым лущенням. Лікування скарлатини передбачає антибактеріальну терапію вище описаними засобами, а також дезінтоксикаційну з допомогою рясного пиття або внутрішньовенних інфузій, антигістамінні засоби.
Бешиха – специфічне запалення шкіри і нижче лежачих тканин внаслідок ураження стрептококом групи А. найчастіше уражаються нижні кінцівки, обличчя і вушні раковини, рідше – тулуб і руки.
ішемічна хвороба серця та атеросклероз, гіпертонічна хвороба, тромбофлебіт і облітеруючий ендартеріїт (будь-які системні і локальні ураження судин), цукровий діабет, грибкові ураження шкіри і нігтів.
Бешихове запалення характеризується появою великої плями на шкірі яскраво-червоного кольору, гарячого і хворобливого на дотик (еритематозна форма). Можливо поява на тлі плями бульбашок з прозорим вмістом (бульозна форма) або кров’яним (бульозної-геморагічна форма).
Саме стрептокок групи А є причиною численних і різноманітних так званих гнійних процесів: від гнійничкових висипань до ураження головного мозку. Локальні ураження (гнійничкові висипання, панарицій, запалення придаткових пазух носа та середнього вуха) можуть спостерігатися практично у кожної людини.
Причиною цього найчастіше є порушення цілісності шкірних покривів або ускладнення попередньої вірусної інфекції. Антибактеріальна терапія сучасними антибіотиками досить ефективна за умови дотримання дозування і тривалості курсу.
Генералізація стрептококової інфекції – сепсис – спостерігається частіше у ослаблених пацієнтів (ВІЛ-інфекція, туберкульоз). Сепсис характеризується проникненням стрептокока в кров і його дисемінацією по всім органам і тканинам, подальшим формуванням вторинних гнійних вогнищ в тканини легенів, серця, головного мозку, печінки.
Стрептококова інфекція здатна ініціювати не тільки власне інфекційні процеси, але і глибокі інфекційно-алергічні реакції. Саме з утворенням специфічних імунних комплексів пов’язують виникнення ревматизму та інших видів ураження сполучної тканини (колагенози), клапанного апарату серця (з формуванням набутих вад серця) та гломерулонефриту.
У таких випадках антибактеріальна терапія абсолютно неефективна. Лікування колагенозів передбачає використання системних гормональних препаратів і симптоматичних засобів. Лікування набутих вад серця можливо лише хірургічним шляхом.
Streptococcus agalactae (група В-стрептококів, бета-гемолітичний стрептокок) навіть в індустріально розвинених країнах, як і раніше, залишається найбільш частим збудником неонатального сепсису. Частота перинатальних інфекцій, спричинених ета-гемолітичним стрептококом, драматично збільшилася до початку 70-х років.
З трьох незалежних робіт у квітневому випуску Journal of Pediatrics 1973 безпосередньо випливало, що бета-гемолітичний стрептокок став найбільш частим збудником неонатального сепсису у США.
В цей час вмирала майже половина уражених стрептококовою інфекцією новонароджених. Також ще і сьогодні неонатальний сепсис — незважаючи на весь прогрес у перинатальній медицині — асоціює з досить значною морбидностью, і навіть летальністю.
Бета-гемолітичний стрептокок дає майже половину ізолятів культур крові, що виділяються в перші дні життя у новонароджених із сепсисом.
Збудник цілком очевидно походить з родових шляхів матері. Чому ж саме бета-гемолітичний стрептокок з такою частотою переходить на новонароджених — до цих пір залишається незрозумілим. Материнський генітальний тракт заселений різноманітними іншими схожими або більш патогенними бактеріями, без того, щоб вони могли грати таку епідеміологічну або подібну роль.
Щонайменше, 10% вагітних в Німеччині колонізовані бета-гемолітичним стрептококом. Майже половина дітей від цих матерів також буде колонізована, з яких, в свою чергу, фактично захворіє тільки невелика частина.
При величині колонізації матерів бета-гемолітичним стрептококом майже 10%, і рівні передачі майже 50%, ризик захворювання новонародженого становить близько 0,2%. При цьому свою роль відіграють такі чинники ризику, як недоношеність, передчасний розрив плодових оболонок, щільність заселення мікроорганізмами та ін; особливе значення крім того повинна мати величина специфічних материнських антитіл.
Іншим, тільки в останні роки дещо краще вивченим феноменом, є надзвичайно сильна активація імунної системи в рамках стрептококової інфекції.
Клінічний спектр системних стрептококових інфекцій у перинатальному періоді досить широкий і поширюється від септичного аборту до транзиторної бактеріємії з слабовыраженным клінічним перебігом.
Не завжди можна виявити які-небудь особливості в анамнезі вагітності і пологів. Навіть у доношених новонароджених, без будь-яких вказівок на материнську лихоманку або синдром інфекції амніона, може протягом декількох годин життя розвинутися важка септична картина захворювання.
Ранній сепсис (early onset) і
Пізній сепсис (late onset)
Зазвичай говорять про ранній формі, якщо розвинувся сепсис протягом першого тижня життя. До пізньої формі відносять септицемії, що почалися з 2 тижня життя до кінця 3 місяця життя. Більше 80% всіх випадків раннього сепсису, спричиненої бета-гемолітичним стрептококом, проявляється в перші 24 години життя.
Як і при інших збудниках, до ранніх ознаками сепсису відносяться порушення дихання (апное, постанывания, тахі – і диспное) і порушена перфузія шкіри (сірувата блідість, мармуровість), а також тахікардія і артеріальна гіпотонія.
Ці клінічні ознаки сепсису однак неспецифічні, класичні реакції гострої фази в крові запізнюються, так що діагноз часто встановлюється досить пізно. Респіраторна недостатність (синдром задишки) і септичний шок часто змушують проводити інтубацію. Іноді протягом блискавично аж до поліорганної недостатності (відмови множинних органів).
Чим більше незрілість новонародженого, тим частіше стрептококова інфекція протікає як важкий сепсис. У доношених новонароджених частіше відзначається пневмонія іноді з тяжкою дихальною недостатністю аж до персистуючої пульмональной гіпертонії новонародженого (PPHN).
Епідеміологія бета-гемолітичного стрептокока
Стрептококи являють собою бактерії кулястої форми, в полі зору зазвичай видно у вигляді недовгих ланцюжків. За допомогою одного з основних видів мікробіологічного фарбування (за методикою доктора Грама) виділяють грамнегативні стрептококи (червоне забарвлення) і грампозитивні (синє забарвлення).
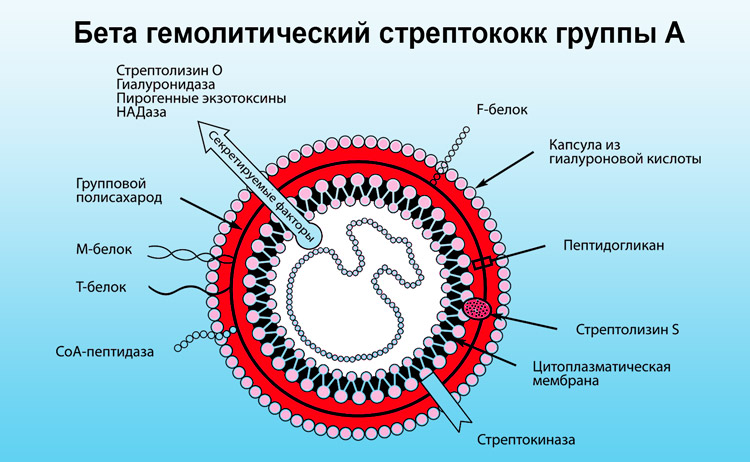
В залежності від наявності певних вуглеводів в клітинній стінці даних мікроорганізмів виділяють кілька груп стрептококів, названих літерами латинського алфавіту. Найбільшу поширеність мають стрептококи групи А, в деяких посібниках звані бета – гемолітичний стрептокок.
Стрептококи складають близько половини нормальної мікрофлори ротоглотки. Слущенний епітелій і залишки їжі є хорошим живильним середовищем для них. Бактерії заселяють також шлунково-кишковий тракт, дихальні шляхи, статеві органи, їх велика кількість мешкає на шкірних покривах.
Зниження імунітету сприяє розвитку важких інфекційних захворювань. У такій ситуації стрептококи починають здобувати патогенні властивості. Особливо багато хворих з ангіни, фарингіти, риніти та іншими захворюваннями стрептококової природи верхніх і нижніх дихальних шляхів реєструється в холодну пору року та після перенесених гострих респіраторних вірусних інфекцій та кору.
Рис. 1. На фото стрептококова ангіна.
На відповідних knockout-моделях вдалося продемонструвати, що імунна активація інактивованих нагріванням цілих клітин бета-гемолітичного стрептокока однозначно залежить від MyD88 і, разом з тим, — від TLR.
Відповідальний TLR, однак, до сих пір не може бути ідентифікований. Як активуючого початку передбачаються складова частина грам-позитивної бактеріальної клітинної стінки, до якої належать полісахариди, пептидгликан і липотейхоновые кислоти.
Проте жоден з цих компонентів не має порівнянним з LPS иммуноактивирующим потенціалом. Надзвичайно сильна иммуноактивация — вимірювана виробленням TNF-a — на відміну від цього індукується сецернируемым стрептококом розчинним фактором (бета-гемолітичний стрептокок-F).
Це додаткове активація бета-гемолітичний стрептокок-F очевидно також опосередковується через різні PRR. Вважається, що CD14, TLR2 і TLR6 діють як корецепторы для бета-гемолітичний стрептокок-F. Бета-гемолітичний стрептокок-F представляється потужним провоспалительным токсином.
Інша гіпотеза, що пояснює виражену імуностимулюючу потенцію бета-гемолітичного стрептокока, що стосується TLR-незалежного шляху активації. У моделі на тваринах, а також на клітинних культурах після стимуляції сецернируемыми бета-гемолітичним стрептококом протеїнами, проявляється олигоклональная експансія певних сімейств Т-клітин, що вельми нагадує станом иммуноактивации суперантигеном.
Суперантигены характеризуються сильним активація CD4 , або CD8 — T-клітин, без того, щоб вони розпізнавалися, як специфічний антиген Т-клітинними рецепторами. У новонароджених з стрептококових сепсисом попередні результати вказують на те, що і при ньому відбувається селективна експансія окремих сімейств Т-клітинних рецепторів.
Звідси клінічно проявляється синдром подібний до синдрому токсичного шоку дуже б добре відповідав часто спостерігається молниености раннього неонатального сепсису. Підтверджується багатьма дослідженнями «цитокіновий штурм» міг би вказувати на масивну активацію імунної ситеми суперантигеном.
Підйом резистентності був пов’язаний із зростанням серотипу V, який досі у Німеччині — на відміну від США і Японії — виділявся досить рідко. За допомогою генетичного аналізу fingerprint можна довести, що резистентні ізоляти ідентичні серотипу V, і разом продемонструвати збільшення резистентності у зв’язку з поширенням окремих резистентних клонів.
Щодо зростаючої резистентності пневмококів і А-стрептококів, а також зростаючого тиску селекції з-за проведення амбулаторної антибіотикотерапії та профілактики матерів, слід побоюватися подальшого зростання резистентності також і бета-гемолітичного стрептокока.
Так як антитіла матері надають основна дія, то щеплення повинна переважно здійснюватися під час або до вагітності, з усіма пов’язаними з цим труднощами.
У цілому ряді клінічних і преклинических досліджень вже вивчені багато з вакцинанальных кандидатів. Так Baker et al. показують, що конъюгатные вакцини, у яких капсульний полісахарид серотипів Ia і Ib пов’язані з правцевим анатоксином, індукують у молодих жінок високий титр антитіл з хорошою активністю опсофагоцитоза.
Проблематичним видається, що вакцини і з ними захисний ефект виявляються серотипспецифическими. З майже 8 серотипів бета-гемолітичного стрептокока тільки окремі обумовлюють більшу частину інвазивних інфекцій у новонароджених, при тому, що відзначаються суттєві регіональні та національні відмінності в розподілах серотипів.
Хоча потенційні вакцини в майбутньому передбачаються полівалентними, тим не менш, не слід очікувати, що можна охопити всі наявні серотипи. Це змушує ще більше звернути увагу на знання національних і регіональних поширення серотипів стрептококової інфекції.
Група В стрептококів сьогодні, як і раніше, є найбільш частим збудником неонатального сепсису та менінгіту. Частота в Німеччині оцінюється в майже 0,5/1000 живонароджень, при чому число негативних по культурі крові клінічних випадків сепсису може виявитися у кілька разів більше.
Ймовірність зустрічі з неонатальним стрептококових сепсисом для клінічного та практичного педіатрів досить велика. Фульминантность early-onset сепсису, а також непомітне поступове початок late-onset сепсису роблять життєво необхідне вміння швидкої постановки діагнозу і діагнозу підозри, а також проведення адекватної терапії.
Незважаючи на зростаючу антибиотикорезистентность, в терапії пеніциліном і аміноглікозидами за останні 30 років нічого не змінилося. Особливе значення сьогодні набуває профілактика.
Національні і міжнародні товариства фахівців рекомендують интранатальную антибиотикопрофилактику у матері на підставі скринінгових досліджень на пізніх термінах вагітності, а також при наявності факторів ризику.
Так як ці стратегії профілактики хоча й ефективні, але не позбавлені своєї проблематики, то можливо, що в майбутньому імунопрофілактика буде здійснюватися вакцинацією матері. Хоча вже і досягнуті багатообіцяючі результати, при цьому на сьогодні ще залишається багато невирішених як практичних, так і етичних питань.
Бета-гемолітичний стрептокок групи А (піогенний стрептокок, БГСА, S. pyogenes) — грамположительный, неспорообразующий, нерухомий мікроорганізм. Зустрічається повсюдно, часто колонізує шкірні покриви і слизові оболонки людини.
Головними шляхами передачі є повітряно-крапельний, контактний та харчовий. Основні форми захворювання представлені поверхневими (ангіни, фарингіт, імпетиго, рожа), інвазивними (некротизуючий фасциит, міозит, менінгіт, ендокардит, пневмонія, післяпологовий сепсис) та токсин-опосередкованими інфекції (скарлатина, синдром токсичного шоку).
Streptococcus pyogenes зберігає 100% чутливість до бета-лактамних антибіотиків (пеніцилінів, цефалоспоринів, карбапенемів). Вони залишаються єдиним класом антибіотиків, до яких у S. pyogenes не розвинулася резистентність.
Актуальною проблемою є стійкість до макролідів, яка в деяких регіонах світу перевищує 30%. Багатоцентрове дослідження резистентності клінічних штамів S. pyogenes, проведене в 2000-2001 рр.
, дозволило вивчити поширеність стійкості, насамперед до макролідів, в різних регіонах Росії. Частота резистентності до еритроміцину варіювала і досягала 11,4%, при цьому не було виявлено штамів, стійких до телитромицину, представника нового класу антибіотиків — кетолидов.
Шляхи передачі інфекції
Головне, що необхідно знати про стрептококової інфекції – вона здатна викликати розвитку важких ускладнень. У першу чергу це стосується БГСА – найбільш поширеного та небезпечного збудника.
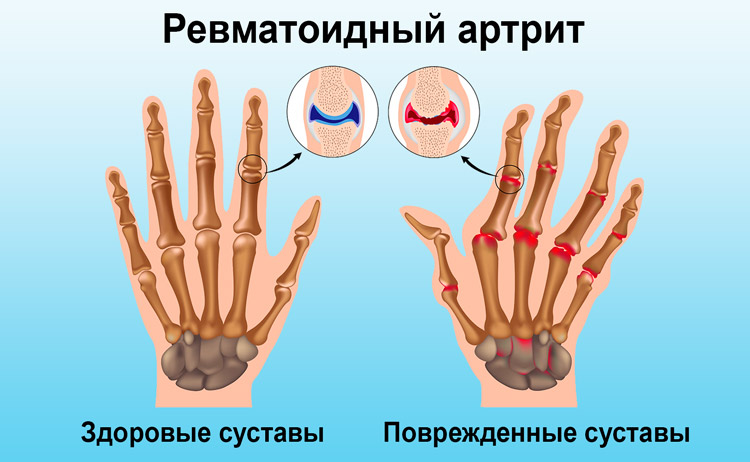
Стрептококові захворювання горла, такі як ангіна та фарингіт, можна вилікувати за тиждень. Якщо ж запустити хворобу, починають розвиватися ускладнення – ревматоїдний артрит, гломерулонефрит та ін
Такі ускладнення доводиться лікувати роками. Саме тому питання про правильному лікуванні стафілококових інфекцій потребує особливої уваги.
Терапія стрептококових інфекцій, в тому числі тонзилофарингіту, в обов’язковому порядку включає прийом антибактеріальних препаратів системної дії (антибіотиків у вигляді таблеток або ін’єкцій). При відмові від антибіотикотерапії істотно зростає ймовірність розвитку ускладнень, що доведено численними медичними дослідженнями.
Звичайно, ускладнення розвиваються не у всіх, але ризикувати не варто. Коли на одній чаші терезів – незначні побічні ефекти антибіотиків, а на іншій – важкі наслідки відмови від них, вибір очевидний.
Перерахуємо ускладнення, які може викликати БГСА:
- гостра ревматична лихоманка;
- ревматична хвороба серця, що вражає клапани і стінку серця;
- постстрептококовий гломерулонефрит, що виявляється у запаленні ниркових клубочків;
- ревматоїдний артрит (запалення суглобів).
Такі ускладнення зазвичай розвиваються через 2-3 тижні після одужання. Всі вищевказані захворювання істотно знижують якість життя і важко піддаються лікуванню.
Як і чому розвиваються постстрептококковые ускладнення? Перший механізм – дія токсинів, що виділяються бактерією. Особливу шкоду стрептококові токсини наносять серця. Другий більш складний механізм.
Справа в тому, що білки клітинної стінки стрептокока за своєю структурою нагадують деякі білки тіла людини, що входять в склад серцевого м’яза, клапанів серця, ниркових мисок, суглобових поверхонь.
Якщо стрептокок затримується в організмі занадто довго (наприклад, при хронічному тонзиліті, затяжному фарингіті), імунна система починає активно знищувати все, що нагадує за будовою клітку стрептокока.
Основа лікування стрептококових інфекцій, спричинених БГСА – антибіотики. Своєчасний прийом антибіотиків не тільки призводить до швидкого зникнення симптомів хвороби, але і попереджає розвиток ускладнень, в тому числі ревматичних.
БГСА володіє високою чутливістю до пеніцилінів, цефалоспоринів та макролідів. Препаратами першого вибору є пеніциліни. Препарати Феноксиметил-пеніцилін і Амоксицилін приймають тричі на день, по 500 мг (тобто
1,5 г на добу). Уточніть дозування у лікуючого лікаря. Вона може варіювати в залежності від віку хворого і тяжкості інфекції. При непереносимості пеніциліну лікар може призначити макроліди – еритроміцин, азитроміцин, кларитроміцин. Схеми лікування даними препаратами призначаються індивідуально.
Препарати гентаміцин, тетрациклін і канаміцин малоефективні по відношенню до бета-гемолітичного стрептокока групи А. Призначати їх при ангіні недоцільно.
Стандартний курс лікування стрептококової інфекції – 10 днів. Виняток – азитроміцин (курс лікування даним препаратом становить 5 днів). При цьому поліпшення спостерігається вже на 2 добу лікування. У цей момент важливо не припиняти лікування. Для повного знищення вогнища інфекції необхідно повністю пройти курс.
Через 2 тижні після одужання рекомендується здати бактеріологічні аналізи, які підтверджують відсутність стрептококової інфекції в організмі.
Розповсюджувачами інфекції є хворі і бактеріоносії. Особливо небезпечно носійство серед працівників пологових будинків.
- Повітряно-крапельний шлях є основним (до 96%) при поширенні інфекції. Дещо рідше відзначається поширення мікробів контактним шляхом і з брудними руками.
- Стрептококи, що знаходяться в статевих шляхах можуть потрапити до партнеру під час статевого акту.
- Вагітна жінка може передати інфекцію новонародженому при пологах.
- Ентеротоксин збудника, який накопичився в харчових продуктах, може стати причиною важкого харчового токсикозу.
Продукти, уражені фекальними стрептококами, ослізняються і набувають неприємного смаку. На перший план в клініці токсикозу виходить лихоманка і поява рідкого стільця. Значно рідше відзначається нудота і блювота.
Рис. 2. Причиною ангін часто є бета-гемолітичні стрептококи.
Рис. 3. На фото бешихове запалення гомілки. Основна причина захворювання — стрептокок.
Якщо порівнювати клінічно і мікроскопічно досить характерні ізоляти бета-гемолітичного стрептокока від здорового колонізованого і хворого на сепсис новонароджених щодо їх потенціалів індукувати експресію різних прозапальних цитокінів, то після стимуляції септичними изолятами викликається більш сильна експресія цитокінів, чим изолятами з звичайних мазків.
Це дозволяє інтерпретувати в тому напрямку, що величина иммуноактивации — особливо неонатальних моноцитів або макрофагів — являє штаммаспецифическую характеристику. Ізоляти, що викликають системну інфекцію та in vivo обумовлюють високу секрецію цитокінів, також характеризуються in vitro більш високим иммунактивирующим потенціалом.
Доказовим для постановки діагнозу стрептококової інфекції виявляється виділення збудника у культурі крові чи ліквору або з інших первинно стерильних рідин організму. Той факт, що у новонароджених з клінічною картиною сепсису виділення збудника через культуру крові не вдається здійснити, являє повсякденну клінічну проблему.
Причини невеликої кількості ізолятів з культур крові чи ліквору при неонатальному стрептококової сепсисі різноманітні. Вони складаються серед іншого і в тому, що бактеріємія не постійна, і в крові новонародженого щільність збудника мала;
Не в останню чергу перешкоджає зростанню збудників з крові дитини і лікування антибіотиками матері до і під час пологів. Іноді вдається виростити бактерії з меконію, секрету шлунка або мазків з вуха і пупкового канатика.
Однак це доводить тільки наявність заселення (колонізації). З чого випливає, що виключне показання до лікування новорожденого виникає тільки тоді, коли інфекція буде підтверджена клінічними симптомами і лабораторними показниками.
Як сурогатного параметра за останні роки в педіатричній практиці, поряд з диференціальною картиною крові та CRP, які проте мають досить обмеженою чутливістю, виправдало себе визначення прозапальних цитокінів, з яких широко і рутинно вже визначаються інтерлейкін (ІЛ)-6 і/або ІЛ-8.
Особливості стрептококів
Стрептококи, як і інші бактерії-коки, мають кулясту форму клітин. Розмножуються вони шляхом простого поділу надвоє.
Стрептокок – бактерія, що постійно циркулює в людських популяціях. Цей мікроорганізм досить довго може зберігатися в повітрі, краплях рідини, але краще всього він себе відчуває всередині людського тіла.
При температурі вище 38°С життєдіяльність стрептокока пригнічується, проте він може виживати при підвищенні температури аж до 60°С.
Стрептокок може довгий час зберігатися в засохлому гною і в’язкої мокротинні, що покриває слизову дихальних шляхів. Завдяки цьому стрептокок може бути причиною хронічних інфекцій.
Поширення інфекції відбувається при контакті здорової людини з хворим – при розмові, поцілунки і т. п. Такий шлях передачі називають повітряно-крапельним. Встановлено, що бактерія також може передаватися алиметарным (харчових) і контактно-побутовим шляхом (при користуванні загальною посудом, рушниками тощо).
Стрептококова інфекція може викликати такі хвороби горла, як:
- банальна ангіна;
- хронічний тонзиліт;
- скарлатина;
- гострий або хронічний фарингіт.
Стрептококи здатні виробляти токсини, які ушкоджують тканини людського організму і сприяють поширенню інфекції по всьому організму. Запальні вогнища у внутрішніх органах носять гнійно-некротичний характер.
Особливість стрептококової інфекції викликати аутоімунний відповідь, призводить до виникнення серйозних ускладнень з боку внутрішніх органів:
- ревматичне ураження серцевого м’яза;
- ураження суглобів (артрити);
- ураження нирок (гломеруло — і пієлонефрити).
При виході мікробів, у кров’яне русло та їх масивному розмноженні може виникнути сепсис і менінгіт.
Рис. 4. Стрептокок — причина сепсису у новонародженого.
Рис. 5. Ураження серця при ревматизмі.
Рис. 6. Ураження суглобів при ревматизмі.
Бактеріологія
Точне бактеріологічне назва виду Streptococcus agalactiae; в клінічній мови увійшло поняття група В стрептококів. Мова йде про факультативних грам-позитивних кокках, розташованих ланцюжком.
На баранячому кров’яному агарі вони дають характерний ріст у формі плоских колоній сірих, оточені вузьким b-гемолітичним двориком з дещо нечітким краєм. Дуже рідко зустрічаються стрептококи серологічної групи В, у яких відсутнє характерне b-гемолитическое прояв, що не робить впливу на вірулентність.
Streptococcus agalactiae має, як і інші гемолизирующие стрептококи — чітко встановленим вуглеводною антигеном, міцно пов’язаним з клітинною стінкою і визначальним групову приналежність (групу).
Крім цього, є капсула з типоспецифических вуглеводів, які ковалентно пов’язані з пептидогликаном клітинної стінки і визначають приналежність до певних серотипам. Найчастотнішими серотипами є Ia, Ib, II, III, IV, V, VI і VIII.
Разом з тим, є цілий ряд не типированных штамів. У дослідженні ESPED-RKI майже 2/3 ізолятів відносяться до III серотипу. На другому місці по частоті зустрічальності Ia і V серотипи, при чому останній в США вже перевершив по частоті III серотип.
Тоді як полісахаридні антигени однозначно ідентифікуються як фактори вірулентності, патогенетичне значення протеїнових антигенів бета-гемолітичного стрептокока залишається менш вивченим. До протеїнів, яким приписується патогенетичне значення, відноситься протеїновий комплекс так званого З-протеїну, який бере участь в резистентності проти опсонізації і интрацеллюлярной загибелі.
Завдяки зв’язуванню людського IgA з поверхнею бактеріальної клітини бета-гемолітичний стрептокок виявляється здатним пов’язувати опсонизирующие антитіла або приховувати інші антигени на клітинній поверхні і пригнічувати фагоцитоз.
Поряд з капсульними полисахарилами і З-протеїном з патогенезом стрептококової інфекції асоціюють та інші фактори вірулентності. До них відносяться CAMP-фактор, гемолизин і, нещодавно ідентифікований протеїн (laminin binding protein, Імр), опосредующий зв’язування бета-гемолітичного стрептокока з ламинином, головною складовою частиною базальної мембрани.
Передбачається, що пошкодження, що наноситься b-гемолизином епітелію легенів, призводить до оголення базальної мембрани і через опосредуемое Imp прикріплення робить можливим проникнення бактерій в кровоносну систему.
Будова і стрептококів
- Стрептококи мають округлу форму. Розташовуються ланцюжками або попарно. Розмножуються шляхом ділення надвоє.
- Швидко гинуть при високій температурі, на сонячному світлі і від дії дезінфікуючих розчинів.
- У зовнішньому середовищі (в пилу, мокротинні, гною) зберігаються місяцями. Добре переносять низькі температури і заморожування.
- Бактерії чутливі до цілого ряду антибактеріальних препаратів. Стійкість до них виробляється поступово.
Рис. 7. На фото стрептококи (комп’ютерна візуалізація).
Фактори патогенності стрептококів
Шкідливу дію бактерій обумовлено ендо – і экзотоксинами і цілим рядом ферментів, які вони виділяють.
- Білок М стрептококів безпосередньо діє на фагоцити, знижуючи їх активність, і на гуморальні механізми імунної відповіді. При його впливі розвиваються аутоімунні реакції. С5а-пептидаза так само пригнічує активність фагоцитів та гуморальні механізми захисту організму. Капсула стрептококів захищає бактерії від фагоцитів і забезпечує адгезію (злипання) з епітелієм. При проникненні стрептококів в тканини, вони здатні самостійно зруйнувати свою капсулу.
- Гіалуронова кислота, з якої утворена капсула, схожа за своєю будовою з гіалуронової кислотою сполучної тканини організму людини, із-за чого стрептокок не розпізнається як чужорідний агент.
- Місце впровадження бактерій відгороджується від оточуючих тканин повільно, що дозволяє мікробам розмножуватися і переміщатися по всьому організму, викликаючи розвиток важких захворювань.
- Стрептолизин Про здатний руйнувати еритроцити і клітини серцевого м’яза.
- Стрептолизин S руйнує еритроцити і фагоцити, які поглинули бактерії.
- Эритрогенные токсини здатні розширювати дрібні судини. Вони зумовлюють появу висипу (наприклад, при скарлатині).
- Кардиогепатический токсин викликає ураження серцевого м’яза, діафрагми і печінки.
- Стрептокіназа сприяє розчинення фібрину і полегшує просування бактерій за сполучної тканини.
- Гіалуронідаза сприяє розщепленню клітинних мембран сполучної тканини, сприяючи поширенню інфекції.
Рис. 8. На фото мелкоточечная висип при скарлатині.
Рис. 9. На фото бешихове запалення гомілки.
Коротка характеристика основних захворювань, які викликає стрептокок групи А.
По здатності руйнувати еритроцити при рості на поживному середовищі «кров’яний агар» стрептококи поділяються на 3 групи (класифікація Брауна. 1919 рік):
- 1-я група — альфа — гемолітичні стрептококи. Вони викликають окислення заліза в молекулах гемоглобіну еритроцитів, що надає зеленувате забарвлення при зростанні бактерій на кров’яному агарі. Стрептококи цієї групи називають «зеленящими».
- 2-я група — бета — гемолітичні стрептококи. Вони викликають повний гемоліз (знищення) еритроцитів. Бактерії цієї групи є причиною безлічі небезпечних захворювань у людини. Існує 20 типів (серогруп) стрептококів, які позначаються великими латинськими літерами (класифікація Ребеки Лэнсфилд. 1933 рік). Найбільш значимі з них бактерії серогрупи A, B, C, D і G.
- 3-я група — гамма — гемолітичні стрептококи. Вони не здатні викликати видимий гемоліз еритроцитів.
У цю групу входять Enterococcus faecium, faecalis, avium і durans і неэнтерококки Streptococcus equinus і bovis. 7.
Рис. 23. На фото фекальні стрептококи.
Патогенні бактерії цієї групи викликають захворювання у великої рогатої худоби і коней. Streptococcus dysgalactiae викликають захворювання подібно тим, які викликають стрептококи групи А.
Про хворобах викликаних стрептококами див. статтю
«Стрептококова інфекція: хвороб багато — один мікроб».
Стрептокок групи А – це грамположительный мікроб, капсул і спор не утворює, джгутиків не має, рухливістю не має. Досить активний з точки зору біохімічної активності: виробляє стрептолизин, дезоксирибонуклеазу, стрептокиназу, гіалуронідазу і кілька інших ферментів. Більшість цих ферментів є факторами агресії стрептокока.
Клінічна діагностика стрептококової інфекції визначається безпосередньо нозологічною формою. Лабораторна діагностика має певні схожі риси.
Традиційним і найбільш широко використовуваним методом лабораторної діагностики є бактеріоскопічний і бактеріологічний методи. При прямій бактеріоскопії в поєднанні з забарвленням по Граму можна побачити в полі зору мікроскопа червонуватого кольору ланцюжка мікроорганізмів, однак, встановити факт наявності гемолітичної активності в результаті використання даного методу неможливо.
Більш детальну інформацію можна отримати за результатами бактеріологічного методу. Для посіву біологічного матеріалу (кров, харкотиння, спинномозкова рідина, слиз з мигдалини, відокремлюване з рани) використовуються основні поживні середовища (мясопептонний агар або кров’яний агар).
Біохімічна активність досліджується за допомогою короткого або довгого ряду Гіса. Результатом цього методу є вичерпна інформація про зовнішньому вигляді бактерії, її культуральних, тинкториальных і біохімічних властивостях, а також чутливість до антибіотиків.
Стрептокок групи А володіє досить високою чутливістю до багатьом групам антибактеріальних препаратів, зокрема, пеніцилінів, цефалоспоринів, карбапенемів. Менша чутливість, відповідно і менша ефективність такої терапії, стрептокока групи А до макролідів, фторхінолонів і тетрацикліну. Цей момент необхідно враховувати при призначенні антибактеріальної терапії.
Пневмокок (Streptococcus pneumoniae)
Носійство пневмококів наголошується в 5 — 70% випадків. Максимальний рівень зареєстрований у дітей організованих колективів.
Пневмококи є основною причиною бронхітів, позалікарняних пневмоній (70% всіх пневмоній), плевритів, захворювань середнього вуха (25% всіх отитів) і синуситів. Вони є причиною ендокардитів і артритів, менінгітів перитонітів.
Низька температура і підвищена вологість є оптимальними для життєдіяльності і розмноження бактерій. Зниження імунітету після перенесених вірусних захворювань і кору сприяє розвитку захворювань.
Рис. 20. На фото стрептококи — пневмококи.
Стрептокок вириданс
Негемолітичні (зеленящие) стрептококи об’єднані загальною назвою — Streptococcus viridans. Вони мешкають у роті і в кишечнику. Дуже легко проникають в кровотік при хірургічному лікуванні або чищенні зубів, тонзилэктомии, інтубації трахеї, викликаючи бактериемию (сепсис).
Бактерії здатні осідати на клапанах серця, що призводить до їх поразки і розвитку тяжких серцевих вад. Хвороба важко піддається лікуванню. Без медикаментозного лікування майже всі хворі гинуть протягом року.
Рис. 21. На фото ревматичний бородавчастий ендокардит. Видно щільні бородавчасті утворення на стулки мітрального клапана.
Стрептококи mutans, anginosus, bovis, mittis і sanguis становлять від 30 до 60% всієї мікрофлори порожнини рота. Вони утворюють на поверхні зубів бактеріальні бляшки. Бактерії здатні ферментировать сахарозу, а молочна кислота, яка виходить в результаті таких реакцій, пошкоджує зубну емаль, викликаючи її демінералізації, що призводить до карієсу.
Рис. 22. Стрептококи разом з іншими бактеріями є причиною карієсу.
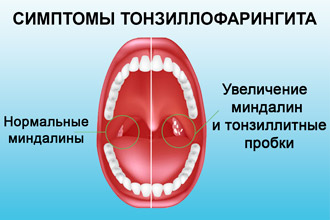
Стрептококовий тонзиллофарингит
Стрептококовий тонзиллофарингит (ангіна) — гостре загальне інфекційне захворювання з переважним ураженням лімфоїдного апарату і слизової оболонки глотки, викликане БГСА. Під рецидивуючим стрептококових тонзиллофарингитом слід розуміти численні епізоди захворювання протягом декількох місяців з позитивними результатами бактеріологічних та/або експрес-методів діагностики БГСА, негативними результатами досліджень між епізодами захворювання, підвищенням титрів протівострептококкових антитіл після кожного випадку хвороби.
Серед бактеріальних збудників гострого тонзилофарингіту найбільше значення має БГСА.
Передача здійснюється повітряно-крапельним, контактним і харчовим шляхами. Джерелами інфекції є хворі, рідше — безсимптомні носії. Імовірність зараження збільшується при високій обсіменіння і тісному контакті.
Інкубаційний період становить від декількох годин до 2-4 днів. Характерно гострий початок з підвищення температури тіла до 37,5-39°С, виражена загальна інтоксикація. Біль у горлі буває так сильно виражена, що у хворого порушується ковтання.
При огляді виявляється почервоніння піднебінних дужок, язичка і задньої стінки глотки. Мигдалини гіперемована, набряклі, часто з гнійним нальотом жовтувато-білого кольору. Наліт пухкий, пористий, легко віддаляється шпателем з поверхні мигдаликів без кровоточить дефекту. У всіх хворих відзначається регіонарний збільшення лімфовузлів.
Тривалість періоду розпалу (без лікування) становить 5-7 днів. Надалі, при відсутності ускладнень, основні клінічні прояви хвороби швидко зникають.
ранні (гнійні), що розвиваються на 4-6-й день від початку захворювання, — отит, синусит, мастоїдит, паратонзіллярний абсцес, шийний лімфаденіт, менінгіт, бактеріємія, ендокардит, пневмонія;
пізні (негнойные): постстрептококовий гломерулонефрит, токсичний шок, що розвиваються в стадії одужання (на 8-10-й день від початку хвороби) і гостра ревматична лихоманка, розвивається через 2-3 тиж після купірування симптомів захворювання — небезпечні, часто призводять до інвалідизації захворювання.
Надзвичайно важливо вчасно встановити етіологію тонзилофарингіту, оскільки, за рідкісним винятком, тільки ангіна стрептококової етіології потребує антибактеріальної терапії. Діагностика включає мікробіологічне дослідження мазка з поверхні мигдалин і/або задньої стінки глотки.
За кордоном широке поширення отримали методи експрес-діагностики, засновані на прямому виявленні стрептококового антигену в мазках з поверхні мигдалин і/або задньої стінки глотки. Сучасні тестові системи дозволяють отримувати результат через 15-20 хв з високою специфічністю (95-100%), але меншою, чим при культуральном дослідженні, чутливістю (60-95%), у зв’язку з чим негативний результат експрес-тесту завжди повинен підтверджуватися культуральним дослідженням (посівом).
Метою антибіотикотерапії гострих стрептококових ангін є ерадикація БГСА, що веде не тільки до ліквідації симптомів інфекції, але і попереджає ранні та пізні ускладнення, а також запобігає поширенню інфекції.
Препаратами I ряду для лікування гострого стрептококового тонзиліту є пеніцилін (феноксиметилпеніцилін), амінопеніциліни та оральні цефалоспорини. У пацієнтів з доведеною алергією на бета-лактамні антибіотики слід застосовувати макроліди, а при непереносимості останніх — линкозамиды.
Згідно з даними, представленим німецькими вченими на 11 Європейському Конгресі з клінічної мікробіології та інфекційних хвороб (ECCMID), 5-денний курс кетолида телітроміцину (Кетек) так само ефективний при лікуванні тонзиллофарингитов, викликаних бета-гемолітичним стрептококом групи А (БГСА), як і 10-денний курс феноксиметилпеніциліну.
У середньому близько 20% дітей шкільного віку є носіями БГСА у весняно-зимовий час. Враховуючи низький ризик розвитку гнійних і негнойных ускладнень, а також незначну роль у поширенні БГСА, хронічні носії, як правило, не потребують антибактеріальної терапії.
Інфекційний мононуклеоз (синоніми: хвороба Філатова, залозиста гарячка, моноцитарна ангіна, хвороба Пфейфера, хвороба поцілунку і ін) — гостра вірусна інфекція, зумовлена вірусом Епштейн-Бар і характеризується лихоманкою, генералізованою лімфаденопатією, тонзиллофарингитом, збільшенням печінки і селезінки та характерними гематологічними змінами.
В даний час проведення диференціального діагнозу між симптоматично подібним інфекційним мононуклеозом та гострим тонзиллофарингитом представляє деякі труднощі. До точної верифікації діагнозу пацієнтам обох груп призначається схожа стартова терапія, а проведення експрес-діагностики з допомогою гемагглютинационного тесту для виявлення наявності гетерофільних антитіл є дорогим методом і може займати від 24 до 48 годин.
Вченими з Великобританії на чолі з Wolf D. M. було проведено ретроспективне пілотне дослідження, за результатами якого було виявлено, що за допомогою показника співвідношення числа лімфоцитів до загального числа лейкоцитів можна швидко і точно провести диференціальний діагноз між інфекційним мононуклеозом та гострим тонзиллофарингитом.
Ретроспективно проаналізовано результати лабораторних аналізів 120 пацієнтів з інфекційним мононуклеозом і 100 пацієнтів з гострим тонзиллофарингитом, мали бактеріальну етіологію.
У всіх пацієнтів проводилась оцінка результатів експрес-тесту на інфекційний мононуклеоз у поєднанні з клінічною картиною захворювання і показниками співвідношення лімфоцити/лейкоцити.
Вчені виявили, що середній показник загального числа лейкоцитів був значно вище в групі пацієнтів з гострим бактеріальним тонзиллофарингитом в порівнянні з групою пацієнтів з інфекційним мононуклеозом (16,5х109/л vs 11,4х109/л), однак кількість лімфоцитів, навпаки, була вищою у пацієнтів в групі з інфекційним мононуклеозом в порівнянні з іншою групою (6,5х109/л vs 1,6х109/л).
При цьому середній показник співвідношення лімфоцити/лейкоцити був достовірно вище (p менше 0,001) в групі пацієнтів з інфекційним мононуклеозом в порівнянні з групою пацієнтів з гострим тонзиллофарингитом, мали бактеріальну етіологію (0,54 проти 0,10).
Новий підхід до диференціального діагнозу між інфекційним мононуклеозом та гострим тонзиллофарингитом
Гостра ревматична лихоманка (ОРЛ) може виникати як після тонзилофарингіту з типовою клінічною картиною, так і після перенесеної безсимптомній чи малосимптомною інфекції. ОРЛ виникає тільки після інфекцій глотки, і ніколи після інфекцій шкіри і м’яких тканин.
В даний час В розвинених країнах гостра ревматична лихоманка зустрічається з частотою 0,5 на 100000 дітей шкільного віку. В країнах захворюваність становить від 100 до 200 на 100000 дітей шкільного віку, щорічно реєструється від 10 до 15 млн. нових випадків ОРЛ, яка є основною причиною смерті від серцево-судинної патології.
Слід зазначити, що невмотивована затримка відновлення працездатності, слабкість, нестійкий субфебрилітет, артралгії, серцебиття і різко підвищена ШОЕ, зберігаються після перенесеної ангіни, в поєднанні зі зростанням титрів протівострептококкових антитіл (антистрептолизин Про, антистрептокиназа, антистрептогиалуронидаза, анти-ДНКаза В) можуть свідчити про дебюті гострої ревматичної лихоманки.
Згідно з рекомендаціями ВООЗ для діагностики гострої ревматичної лихоманки у якості міжнародних застосовуються критерії Джонса, переглянуті Американською кардіологічною асоціацією в 1992 р. (див. табл.).
Наявність двох великих критеріїв або одного великого і двох малих в поєднанні з даними, документовано підтверджують попередню БГСА-інфекцію, свідчить про високу ймовірність ОРЛ. Однак ні один діагностичний критерій не є строго специфічним для ОРЛ, тому труднощі в ранньому розпізнаванні захворювання та диференціальній діагностиці з іншими нозологіями зберігаються раніше.
Критерії Джонса, що застосовуються для діагностики першої атаки ревматичної лихоманки (за станом на 1992 р.)
Підвищені гострофазові реактанты:ШОЕ, С-реактивний белокУдлинение інтервалу PR на ЕКГ Позитивна А-стрептококова культура, виділена з зіву, або позитивний тест швидкого визначення А-стрептококового антигену.Підвищені або підвищені титри протівострептококкових антитіл
Ревмокардит — провідний синдром ОРЛ. Для нього характерно: хронологічна зв’язок з БГСА-інфекцією горла (ангіна), латентний період 2-4 тиж., молодий вік хворого, переважно гострий або підгострий початок, поліартрит або гострі артралгії в дебюті хвороби, «пасивний» характер кардіальних скарг, наявність вальвулита в поєднанні з міокардитом або перикардитом, висока рухливість симптомів кардиту, кореляція лабораторних і клінічних ознак активності хвороби.
Ревматичний поліартрит характеризується доброякісність, короткочасністю і летючість ураження переважно великих і середніх суглобів з швидким (2-3 тиж.) зворотним розвитком запальних змін у них, особливо під впливом сучасної протизапальної терапії (протягом декількох годин або днів).
Ревматична хорея (мала хорея, хорея Сиденгама) розвивається переважно у дитячому і рідше в підлітковому віці. Провідний клінічний синдром — хореические гіперкінези, найбільш виражені в м’язах дистальних відділів кінцівок і мімічної мускулатури обличчя.
Вони можуть поєднуватися з м’язовою гіпотонією, розлади координації, психічними та вегетативними порушеннями. Тривалість атаки ОРЛ у вигляді малої хореї становить від 3 до 6 міс., однак залишкові явища можуть зберігатися до 1 року.
Кільцеподібна (анулярна) еритема в останні роки зустрічається досить рідко (4-17% випадків), в основному у дитячого контингенту хворих ОРЛ. Клінічно еритема являє собою блідо-рожеві кільцеподібні варіює в розмірах висипання, локалізуються головним чином на тулуб і проксимальних відділах кінцівок (але не на обличчі).
Лікування: застосовують антибактеріальні препарати, НПЗЗ, глюкокортикоїди (преднізолон, метилпреднізолон).
Профілактика: першорядне значення має своєчасна діагностика та адекватне лікування стрептококових інфекцій. При проведенні інвазивних втручань пацієнтам з ревматичними вадами серця показане профілактичне призначення антибіотиків.
Інфекції, викликані бета-гемолітичним стрептококом групи А: тонзиллофарингит, ревматична лихоманка, бешиха
Рожа — інфекційне захворювання, яке характеризується вогнищевим серозним або серозно-геморагічним запаленням шкіри, лихоманкою і інтоксикацією.
Найчастіше пику викликає БГСА, але зустрічаються і стрептококи груп В, С і D. Вхідними воротами для інфекції можуть служити рани, садна, псоріатичні, екзематозні і герпетичні вогнища.
обличчя з недостатністю лімфовідтоку і венозною недостатністю схильні до рецидивуючого перебігу бешихи. У осіб з хронічним тонзиллофарингитом рожа зустрічається в 5-6 разів частіше.
Інкубаційний період від декількох годин до 5 діб. Діагноз, як правило, не викликає труднощів зважаючи характерних місцевих (вогнище ураження різко обмежений, гіперемована, підноситься над навколишньою неураженої шкіри, з блискучою напруженою поверхнею, болючий при пальпації;
нерідко розвиваються бульбашки, булли; іноді відзначається регіонарна лімфаденопатія) і загальних (підвищення температури тіла, загальне нездужання) проявів. Частіше уражаються нижні кінцівки, хоча можуть також уражатися руки, обличчя. Найбільш часто зустрічається у молодих і 50-60-літніх пацієнтів.
Лабораторна діагностика: лейкоцитоз (більше 15000), виявлення антістрептолізіна Про, антістрептогіалуронідази, антістрептокінази. Виділити збудник з осередку ураження нелегко, іноді вдається отримати гемокультуру.
Препарати вибору: при інфекції середньої тяжкості дорослим і дітям старше 10 років застосовують феноксиметилпеніцилін, при тяжкому перебігу — бензилпеніцилін, з подальшим переходом на феноксиметилпеніцилін (ступінчаста терапія).
Альтернативні препарати: при алергії на бета-лактами — макроліди, линкозамиды. Тривалість терапії: не менше 14 днів. При частих рецидивах бешихи профілактично вводять бензатин бензилпеніцилін 1 раз в місяць.
Профілактика стрептококових інфекцій
В цілях профілактики рекомендується дотримувати правила особистої гігієни. Але в зв’язку з широкою поширеністю в популяції збудника ці заходи не дають бажаного результату. Великі надії покладаються на створення вакцини, яка містить фрагменти М-протеїнів БГСА, не вступають у перехресне реагування з тканинними антигенами людського організму.
Зареєстрованої вакцини проти БГСА інфекції поки ще не створено. Лише один препарат знаходиться в стадії клінічного дослідження (II фаза). Препарат StreptAvax компанії ID Biomedical складається з ділянок М-білка 26 найбільш поширених серотипів БГСА, що викликають гострий тонзиллофарингит, ОРЛ, некротизуючий фасциит і синдром стрептококового токсичного шоку.
Хоча вакцина не запобіжить всі випадки інфекції, вона призведе до значного зниження захворюваності, носійства, а отже, і поширеності в популяції збудника.
Профілактику інфекції верхніх дихальних шляхів серед контактних з хворим тонзиллофарингитом слід проводити томицидом


